Enzimas são grupos de substâncias orgânicas de natureza normalmente proteica com atividade intracelular ou extracelular que têm funções catalisadoras,catalisando reações químicas que, sem a sua presença,dificilmente aconteceriam. Isso é conseguido através do abaixamento da energia de ativação necessária para que se dê uma reação química, resultando no aumento da velocidade da reação e possibilitando o metabolismo dos seres vivos. A capacidade catalítica das enzimas torna-as adequadas para aplicações industriais, como na indústria farmacêutica ou na alimentar.
Em sistemas vivos, a maioria das reações bioquímicas dá-se em vias metabólicas, que são sequências de reações em que o produto de uma reação é utilizado como reagente na reação seguinte. Diferentes enzimas catalisam diferentes passos de vias metabólicas, agindo de forma concertada de modo a não interromper o fluxo nessas vias. Cada enzima pode sofrer regulação da sua atividade, aumentando-a, diminuindo-a ou mesmo interrompendo-a, de modo a modular o fluxo da via metabólica em que se insere. O ramo da Bioquímica que trata do estudo das reações enzimáticas é a enzimologia.
As atividades enzimáticas
As enzimas convertem uma substância, chamada de substrato, noutra denominada produto, e são extremamente específicas para a reação que catalisam. Isso significa que, em geral, uma enzima catalisa um e só um tipo de reação química. Consequentemente, o tipo de enzimas encontradas numa célula determina o tipo de metabolismo que a célula efetua.
A velocidade da reação catalisada por uma enzima é aumentada devido ao abaixamento da ativação necessária para converter o substrato no produto. O aceleramento da reação pode ser da ordem dos milhões de vezes: por exemplo, a enzima orotidina-5'- fosfato descarboxilase diminui o tempo da reação por ela catalisada de 78 milhões de anos para 25 milissegundos. Como são catalisadores, as enzimas não são consumidas na reação e não alteram o equilíbrio químico dela.
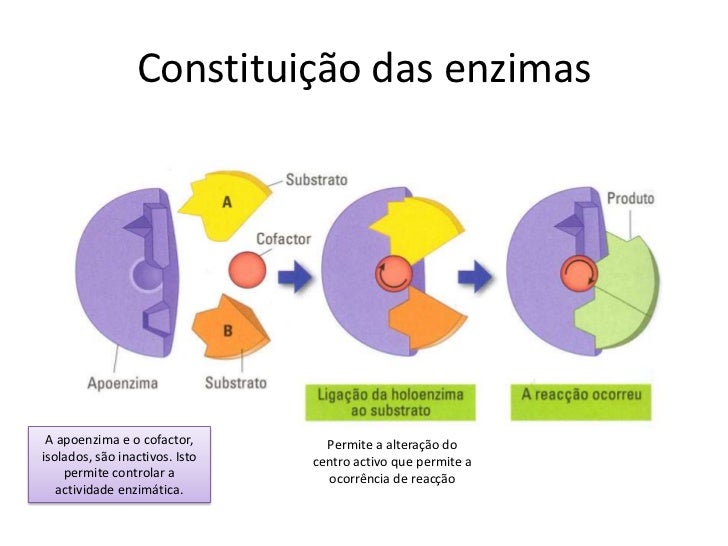
A atividade enzimática pode depender da presença de determinadas moléculas, genericamente chamados cofatores. A natureza química dos cofatores é muito variável, podendo ser, por exemplo, um ou mais íons metálicos (como o ferro), ou uma molécula orgânica (como a vitamina B 12 ). Estes cofatores podem participar ou não diretamente na reação enzimática.
Determinadas substâncias, podem inibir a atividade de algumas enzimas, diminuindo-a ou eliminando-a totalmente; são os chamados inibidores enzimáticos.
Pelo fato de serem proteínas com estrutura terciária ou quaternária, os enzimas são dotadas de dobramentos tridimensionais em suas cadeias polipeptídicas, o que lhes confere uma forma característica e exclusiva. Assim, diferentes enzimas têm diferentes formas e, portanto, diferentes papéis biológicos. Para que um enzima atue, é necessário que os substratos se encaixem na enzima.
Esse encaixe porém, depende da forma, isto é, do contorno da enzima. Por isso, substratos que se encaixam em uma determinada enzima não se encaixam em outras diferentes, e a reação não ocorre; daí a especificidade das enzimas quanto aos substratos em que atuam. Uma vez ocorrido o encaixe forma-se o complexo enzima-substrato, que se assemelha ao sistema chave-fechadura. O local da enzima onde o substrato se encaixa é denominado sítio ativo (ou centro ativo). No caso de substâncias que reagem entre si, sob a ação catalisadora das enzimas, a reação é facilitada, tornando-se mais rápida, pois a proximidade entre as moléculas encaixadas acelera o processo reativo; após a reação, a enzima desliga-se do substrato e permanece intacta.
Números: 04;05;16;23;25;30

Imagens:02;03;06;17;37;40
Nenhum comentário:
Postar um comentário